Organiske stoffers opbygning
Carbon er et karakteristisk eksempel på et grundstof, der danner covalente bindinger. Fire af carbonatomets elektroner kan ved parring med elektroner fra op til fire andre atomer indgå i covalente bindinger. Ved forbindelse med fire hydrogenatomer opstår stoffet methan (CH4), som er en luftart og udgør hovedparten af naturgas.
Carbonatomer har en særlig evne til at forbinde sig med hinanden i lange rækker.
Til stoffet methan svarer en række stoffer med 2, 3 osv. carbonatomer i række.
De fire første stoffer er luftarter, de næste er væsker ved stuetemperatur. Derefter bliver stofferne mere og mere tungtflygtige og til sidst faste, jo længere molekylerne bliver. Når der bliver rigtigt mange carbonatomer i række, fx 1.000, har vi stoffet polyethylen, den plast, der har den enkleste opbygning.
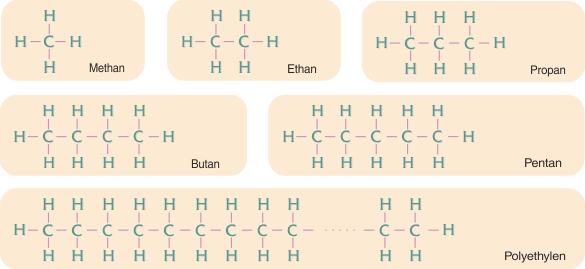
Der består således et nært slægtskab mellem plastpolymererne – dog især polyethylen og polypropylen – og stoffer i ovennævnte række.
Bindingerne mellem carbonatomerne i stofferne i denne række er
enkeltbindinger. Der findes imidlertid også lignende stoffer, hvori der forekommer dobbeltbindinger mellem carbonatomer. Enkeltbindinger dannes af ét par elektroner, én elektron fra hvert af naboatomerne; mens dobbeltbindinger dannes af to elektronpar, to elektroner fra hvert af nabo-atomerne.
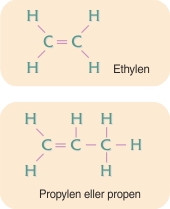
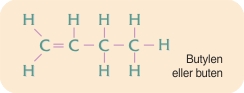
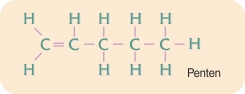
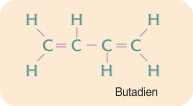
Forbindelser med flere dobbeltbindinger forekommer også, fx butadien. Tredobbeltbindinger dannet af tre elektronpar forekommer også. Det enkleste stof med en tredobbeltbinding mellem to carbonatomer er acetylen.
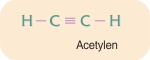
Det her beskrevne er grundlaget for hele den organiske kemi og dermed også for polymer- og plastkemien.
Forbindelser, der udelukkende indeholder enkeltbindinger mellem carbonatomerne, kaldes mættede, mens blot en en-kelt dobbelt- eller tredobbeltbinding gør stoffet til en umættet forbindelse.
