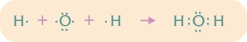Kemiske bindinger
Når atomer forbinder sig med hinanden til molekyler eller på anden måde, sker det, ved at elektronerne arrangerer sig på særlige måder. Man kender tre forskellige typer af kemiske bindinger.
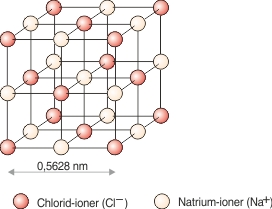
Ionbindingen er baseret på elektronoverførsel, idet en eller flere elektroner skifter plads fra et atom til et andet. Derved opstår elektrisk ladede atomer, som kaldes ioner. Da positivt og negativt ladede partikler tiltrækker hinanden, vil det også ske med positive og negative ioner. De lejrer sig i velordnede gitterstrukturer og danner krystaller. Et kendt eksempel er køkkensalt, som er natriumchlorid.
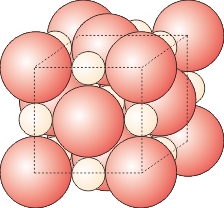
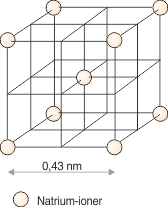
Metalbindingen er baseret på elektronfrigørelse, idet nogle af elektronerne i metallernes atomer er så løst knyttet til atomets kerne, at de i en metalkrystal ikke kan siges at tilhøre et bestemt atom. Man må snarere forestille sig en metalkrystal som en samling tæt pakkede metalioner, hvorimellem elektronerne befinder sig overalt og på grund af deres løse tilknytning til bestemte atomer er frit bevægelige. Denne model kan forklare stoffernes metalkarakter, først og fremmest deres store elektriske ledningsevne.
Den tredje bindingstype kaldes den covalente binding eller atombindingen. Den covalente binding baseres på elektronfællesskab, idet et eller flere elektronpar er fælles mellem to naboatomers kerner. Derved dannes molekyler. Luftarterne oxygen (O2), hydrogen (H2), nitrogen (N2) og chlor (Cl2) består i virkeligheden ikke af atomer, men af toatomige molekyler, hvori atomerne er holdt sammen af covalente bindinger. Vand (H2O) og ammoniak (NH3) er eksempler på kemiske forbindelser af covalent bundne atomer.
I polymererne er det covalente bindinger, der dominerer.