Tilstandsformer hos lavmolekylære stoffer
Lavmolekylære stoffer forekommer normalt i tre forskellige tilstandsformer: Fast, flydende og luftformig. Hvilken af tilstandsformerne, der er til stede i et aktuelt tilfælde, afhænger hovedsageligt af temperaturen. Stoffernes egenskaber er afgørende forskellige i de forskellige tilstandsformer.
Fast tilstandsform er karakteriseret ved forekomsten af et bestemt volumen og en bestemt form. Er molekylerne eller atomerne regelmæssigt ordnet, er stoffet krystallinsk; er molekylerne uordnede, er stoffet amorft.
Flydende tilstandsform, væske, er karakteriseret ved et bestemt volumen, men en ubestemt form.
Luftformig tilstandsform, gas, karakteriseres ved ubestemt volumen – en luftart udfylder hele det rum, den befinder sig i – og ubestemt form.
Overgangen fra en tilstandsform til en anden sker ved ganske veldefinerede temperaturer for hvert enkelt stof.
Når et stof omdannes fra fast til flydende tilstand, siger man, at det smelter. Når det modsatte sker, siger man, at det størkner eller fryser. Den temperatur, hvorved omdannelsen sker, kaldes stoffets smeltepunkt (smeltetemperatur), frysepunkt eller størkningspunkt (frysetemperatur).
Overgår et stof fra flydende til luftformig tilstand, fordamper eller koger det, mens det fortættes eller kondenseres, når det omdannes fra luftformig til flydende tilstand. Omdannelsestemperaturen kaldes tilsvarende for kogepunkt (evt. fordampningstemperatur) eller fortætningspunkt (fortætningstemperatur).
Tilstandsformerne repræsenterer forskellige energiindhold. Ved højere temperatur tilføres et stof så megen energi, at de bevægelser og svingninger, der altid foregår i atomer og molekyler, øges. Ved fortsat energitilførsel vil først de sekundære bindingskræfter, der holder fx ionerne i et salt på plads i et krystalgitter – og dermed gør stoffet fast – overskrides med det resultat, at stoffet smelter. Senere vil de bindingskræfter, der stadig holder stoffet sammen til en væske, også overskrides: stoffet fordamper. I dampfasen virker ingen intermolekylære kræfter, men kun de primære bindingskræfter, som stadig holder atomerne sammen til molekyler.
Omdannelserne mellem de tre tilstandsformer, fast, flydende og luftformig, kaldes 1. ordens omdannelser.
Et stofs specifikke volumen (m3/kg) ændres markant, når smeltepunktet passeres.
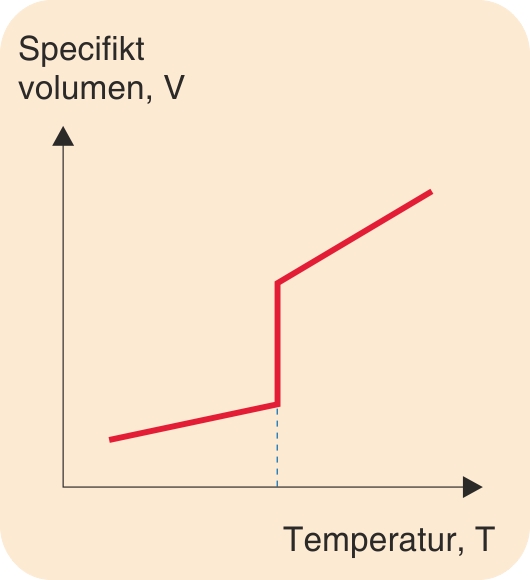
Desuden er typisk også egenskabernes temperaturafhængighed forskellige i forskellige tilstandsformer. På figuren, der viser ændringer af specifikt volumen med temperaturen, angiver kurvens forskellige hældninger, at den termiske udvidelseskoefficient er forskellig i fast og i flydende tilstand.
